

医疗器械国内市场服务方案
如果您是医疗器械制造商、贸易商,希望在国内合规生产和销售。我们能为您提供如下的服务方案:
1. 医疗器械制造商(生产型企业)
· 一类医疗器械—产品备案证、生产备案证办理
· 二类/三类医疗器械—产品注册证、生产许可证办理
· 协助建立医疗器械管理体系GMP
· 二类医疗器械—经营备案证办理
· 三类医疗器械—经营许可证办理
· 协助建立医疗器械经营管理体系GSP
一、针对医疗器械制造商(生产型企业)
1、医疗器械 备案/注册分类
根据《医疗器械监督管理条例》(国务院令第650号)的规定,对中华人民共和国境内的医疗器械按照风险程度实行分类管理。共分3类,分别是第I类、第II类、第III类。
备案/注册分类
|
器械等级 |
备案or注册 |
受理机构 |
证件 有效期 |
受理时间 (工作日) |
|
一类 |
备案 |
设区的市级食品药品监督管理部门 |
永久 |
当场备案 |
|
二类 |
注册 |
省、自治区、直辖市食品药品监督管理部门 |
5年 |
3天 受理机构->评审中心 60天 评审中心->受理机构 20天 受理机构->申请者 10 天 受理机构发证 |
|
三类 |
注册 |
国家食品药品监督管理总局 |
5年 |
3天 受理机构->评审中心90天 评审中心->受理机构 20天 受理机构->申请者 10天 受理机构发证 |
2、医疗器械 生产备案/生产许可证
生产备案/生产许可证
|
器械等级 |
生产备案 Or 生产许可证 |
受理机构 |
证件 有效期 |
受理时间 (工作日) |
现场审核依据 |
|
一类 |
生产备案 |
所在地设区的市级人民政府食品药品监督管理部门 |
永久 |
当场备案 |
/ |
|
二类 |
生产许可证 |
所在地省、自治区、直辖市人民政府食品药品监督管理部门 |
5年 |
30天受理机构审核 10天发证 |
医疗器械生产质量管理规范 (2014年第64号) |
|
三类 |
生产许可证 |
所在地省、自治区、直辖市人民政府食品药品监督管理部门 |
5年 |
30天 受理机构审核 10天 发证 |
医疗器械生产质量管理规范 (2014年第64号) |
3、医疗器械 备案/注册 生产备案/生产许可证流程和周期
第一类医疗器械首次备案流程
第Ⅰ类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械,境内生产企业需要在所在地设区的市级药监局进行备案,境外医疗器械生产企业需要委托境内代理人在国家药监局进行备案。
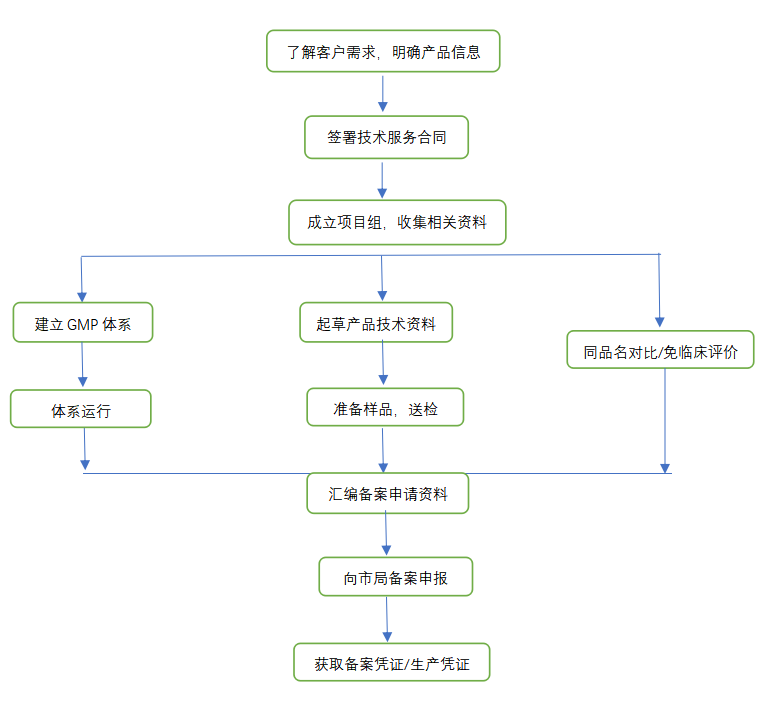
通常备案周期为30个工作日,如需要提供整改资料,时间另算。
第二、三类医疗器械首次注册流程
第Ⅱ类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械,境内生产企业需要在所在地省(直辖市)药监局进行注册,境外医疗器械生产企业需要委托境内代理人在国家药监局进行注册。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在国家药监局进行注册。
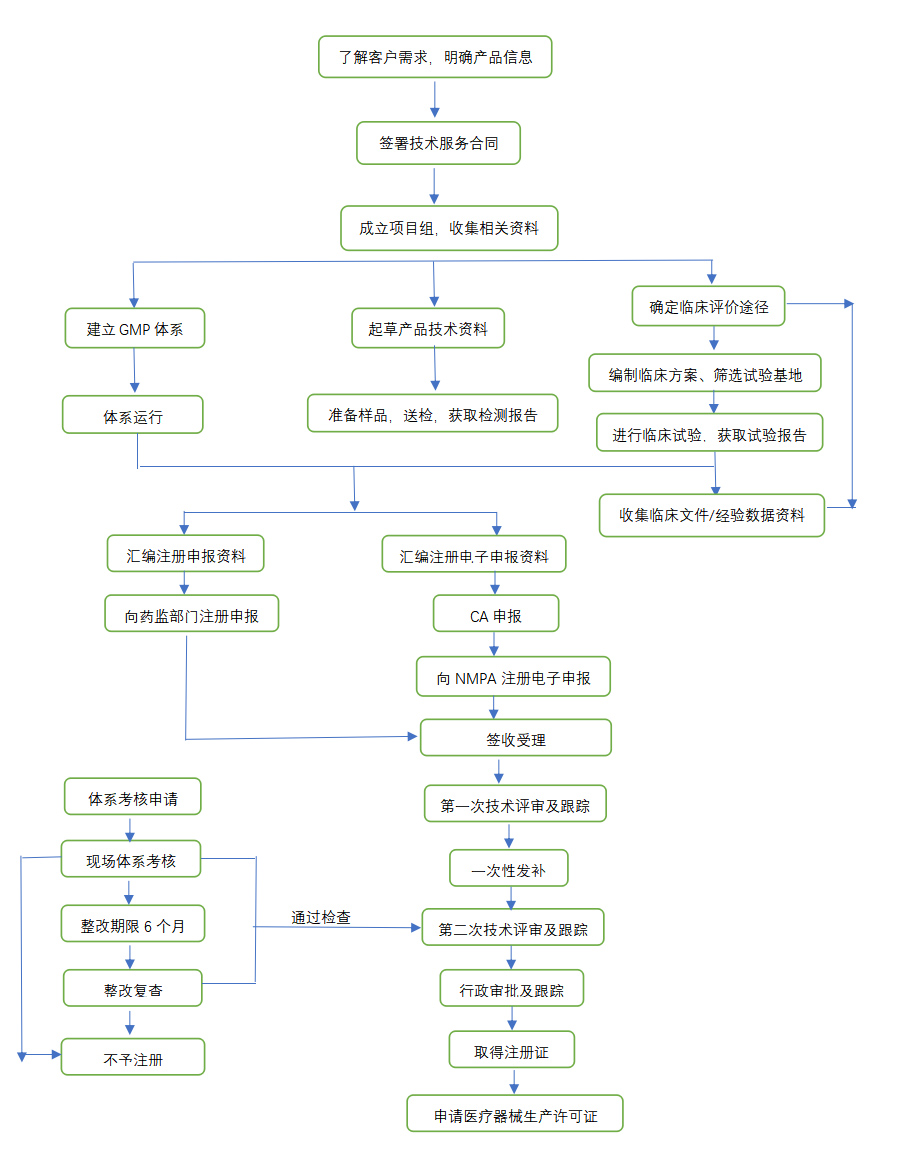
通常注册周期为240个工作日,如需提出整改资料,时间另算。
现场体系考核
|
器械等级 |
质量管理体系 核查机构 |
完成时间 (工作日) |
考核依据 |
|
一类 |
/ |
/ |
/ |
|
二类 |
省、自治区、直辖市食品药品监督管理部门 |
30天 |
医疗器械生产企业质量体系考核办法(局令第22号) |
|
三类 |
(国家局通知,必要时参与)省、自治区、直辖市食品药品监督管理部门 |
30天 |
医疗器械生产企业质量体系考核办法(局令第22号) |
4、GMP质量体系
依据:
《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)
《医疗器械生产质量管理规范》(2014年第64号)
指导原则:
218-1现场检查指导原则
218-2无菌医疗器械现场检查指导原则
218-3植入性医疗器械现场检查指导原则
218-4体外诊断试剂现场检查指导原则
医疗器械生产质量管理规范定制式义齿现场检查指导原则
指南
医疗器械工艺用水质量管理指南
医疗器械生产企业供应商审核指南
医疗器械生产企业质量管理体系年度自查报告
一次性使用塑料血袋等21种医疗器械生产环节风险清单和检查要点
一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点
医疗器械生产企业质量控制与成品放行指南
协助建立GMP质量体系服务流程及周期
1) 依据GMP要求对企业现状进行差距分析,提出整改计划
2) 指导企业依照整改计划进行整改,并核查整改情况
3) 协助指导企业编制相关的体系文件和记录
4) 对相关人员进行培训
5) 指导企业应对审核,协助企业对审核开具的不符合项进行整改
通常体系建立周期为60个工作日。
二、针对医疗器械贸易商(贸易型企业)
1、经营备案/许可证
|
器械等级 |
经营备案Or许可证 |
受理机构 |
证件 有效期 |
受理时间 (工作日) |
现场审核依据 |
|
一类 |
无需备案或许可证 |
/ |
/ |
/ |
/ |
|
二类 |
备案 |
所在地设区的市级食品药品监督管理部门 |
永久 |
当场备案 |
3个月内 《医疗器械经营质量管理规范》(2014年第58号) |
|
三类 |
许可证 |
所在地设区的市级食品药品监督管理部门 |
5年 |
30天 受理机构审核 10天 发证 |
《医疗器械经营质量管理规范》(2014年第58号) |
2、医疗器械 经营备案/许可证的流程和周期
经营备案流程及周期
1)提交办理申请及相关材料。药监部门查验申请资料是否符合基本要求,材料符合要求予以当场办理备案。
通常备案周期为30个工作日,如需要提供整改资料,时间另算。
许可证的流程和周期
1)提交办理申请及相关材料。药监部门查验申请资料是否符合基本要求,决定是否受理或不予受理申请的决定。
2)现场审核。药监部门指派一至三名审核员至企业经营现场审核,如不符合要求可要求企业进行整改,如整改后仍不满足要求的给出不予许可通知。
3)发放证书。药监部门根据相关资料决定是否给予企业发放经营许可证,并在相关网站上对其企业相关信息进行公示,公示后无异议的则通知企业领取医疗器械经营许可证。
经营备案/许可证的报价原则
通常许可证办理周期为60个工作日,如需要提供整改资料,时间另算。
3、GSP质量体系
依据:
《医疗器械经营监督管理办法》(国家食品药品监督管理总局令第8号)
《医疗器械经营质量管理规范》(2014年第58号)
指导原则:
《医疗器械经营质量管理规范现场检查指导原则》
指南
医疗器械冷链(运输、贮存)管理指南
协助建立GSP质量体系服务流程及周期
1) 依据GSP要求对企业现状进行差距分析,提出整改计划
2) 指导企业依照整改计划进行整改,并核查整改情况
3) 协助指导企业编制相关的体系文件和记录
4) 对相关人员进行培训
5) 指导企业应对审核,协助企业对审核开具的不符合项进行整改
通常体系建立周期为30个工作日。

医疗器械国内市场报价方案
医疗器械产品备案证、生产备案证的报价原则:
医疗器械备案证办理的收费分为技术服务费和行政费用。行政费用以当地药监局公布的信息为准,技术服务费报价原则如下:
1) 生产备案证通常是一个企业一个费用;
2) 产品备案证的报价基于产品数量多少来决定报价。
医疗器械产品注册证、企业生产许可证的报价原则:
医疗器械产品注册证和企业生产许可证的收费分为技术服务费和行政费用。行政费用以当地药监局公布的信息为准,技术服务费报价原则如下:
1) 企业生产许可证通常是一个企业一个费用;
2) 产品注册证的报价基于产品数量多少来决定报价。
GMP体系报价原则
GMP的辅导需要在现场开展、因此收费原则是按照人日数来进行。而决定辅导人日数的因素包括:
1) 企业的规模和生产的医疗器械的品类多少;
2) 产品风险等级划分情况;
3) 企业自身的基础,例如是否通过ISO13485,是否有文件化的管理体系。
GSP体系报价原则
GSP的辅导需要在现场开展、因此收费原则是按照人日数来进行。而决定辅导人日数的因素包括:
1) 企业的规模和销售的医疗器械的品类多少;
2) 产品风险等级划分情况;
3) 企业自身的基础,例如是否通过ISO13485,是否有文件化的管理体系。





