产品备案和生产备案
一、主要法规依据
《医疗器械监督管理条例》
《医疗器械生产监督管理办法》
《医疗器械注册管理办法》
《国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告》
《医疗器械生产质量管理规范》
二、备案申报
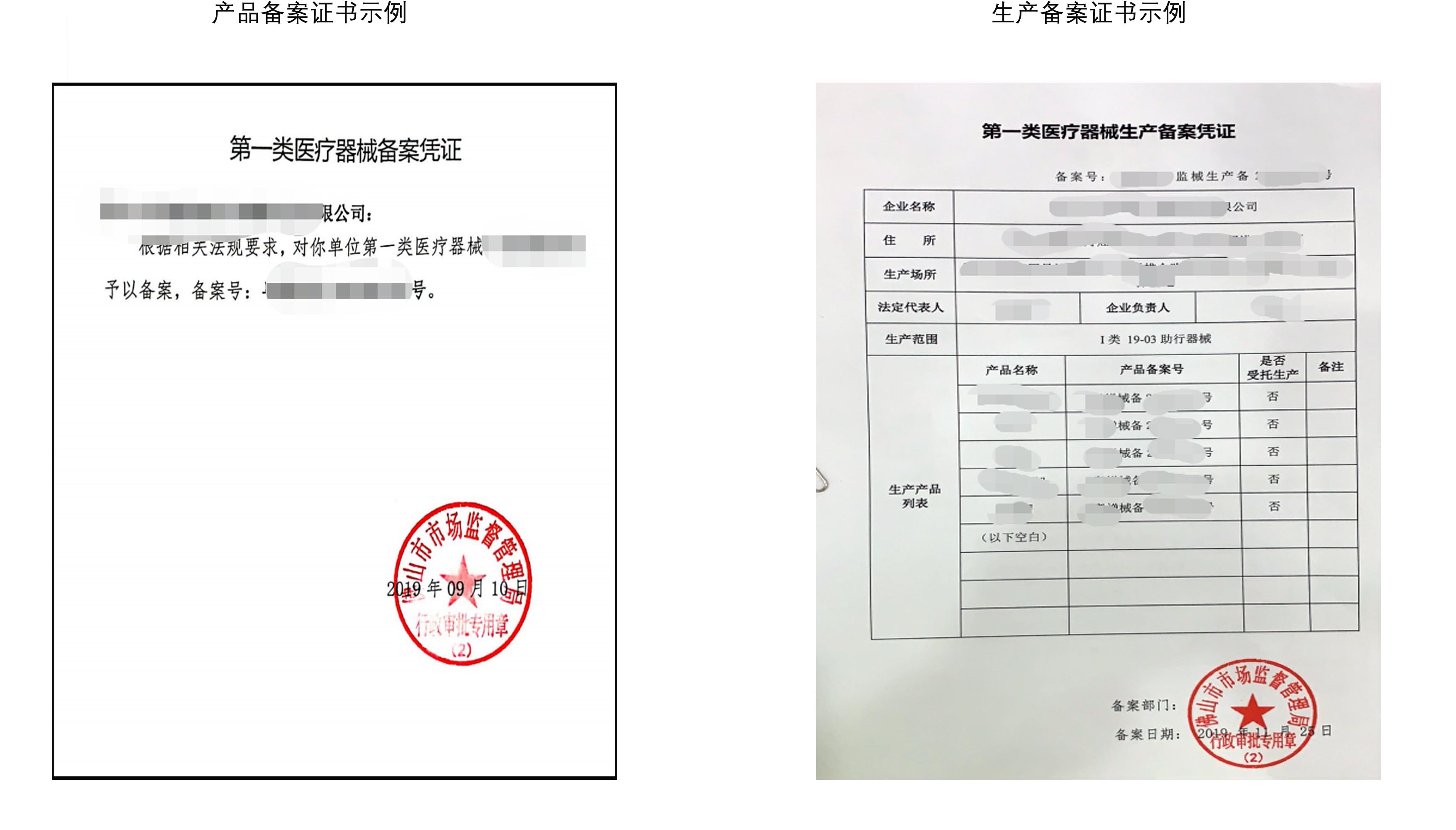
证书类型:产品备案证&生产备案证
对于国内I类医疗器械产品,需要具备产品备案证书和生产备案证,才可以在国内正式生产销售。
备案流程:
第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府食品药品监督管理部门提交备案资料。
其中,产品检验报告可以是备案人的自检报告;临床评价资料不包括临床试验报告,可以是通过文献、同类产品临床使用获得的数据证明该医疗器械安全、有效的资料。此外,对于进口的一类医疗器械,由境外生产企业在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。
生产备案申报在取得产品备案后进行申报,一般应向当地设区的区级食药监管部门提交生产备案。
体系考核:
申请一类医疗器械备案的企业应按照《医疗器械生产质量管理规范》要求,结合产品特点,建立健全与所生产医疗器械相适应的质量管理体系,并保证其有效运行。
GMP质量管理体系涉及的检查内容主要包括以下:
(一)机构和人员
(二)厂房与设施
(三)设 备
(四)文件管理
(五)设计开发
(六)采 购
(七)生产管理
(八)质量控制
(九)销售和售后服务
(十)不合格品控制
(十一)不良事件监测、分析和改进
证书维护更新:
产品备案证和生产备案证永久有效。
当备案资料载明的事项发生变化的,应当向原备案部门变更备案。
三、申报文件
产品备案申请资料一般包括以下:
(一)产品备案申请表
(二)产品风险分析资料
(三)产品技术要求
(四)产品检验报告
(五)临床评价资料
(六)生产制造信息
(七)产品说明书及标签样稿
(八)证明性文件
(九)符合性声明
(十)授权办事委托
生产备案申请资料一般包括以下:
(一)第一类医疗器械生产备案表;
(二)所生产产品的医疗器械备案凭证;
(三)经备案的产品技术要求;
(四)营业执照;
(五)法定代表人、企业负责人身份证;
(六)生产、质量和技术负责人的身份、学历职称证明;
(七)生产管理、质量检验岗位从业人员、学历职称一览表;
(八)生产场地证明文件(租赁合同/产权证明);
(九)主要生产设备和检测设备目录;
(十)质量手册和程序文件;
(十一)工艺流程图;
(十二)申请材料真实性的自我保证声明;
(十三)经办人授权证明。
四、服务内容
SUNGO可提供中国法规的相关服务,包括:
· 制定申请解决方案
· 医疗器械分类界定申报
· 协助企业建立GMP或GSP管理体系
· 编写医疗器械备案/注册申报材料
· 协助企业获得产品备案/生产备案证
· 协助企业获得产品注册证/生产许可证/经营许可证
· 协助进口医疗器械获得产品备案/注册证
· 医疗器械法规培训辅导
· 延续注册/许可事项变更/登记事项变更
· 生产许可延续/生产许可变更
五、服务流程
|
流程 |
具体任务 |
分工 |
周期 |
|
1 |
企业提供初步产品信息,SUNGO确定产品分类,确定申报 路径 |
双方 |
2-3工作日 |
|
2 |
SUNGO与企业签订合作协议 |
双方 |
2-3工作日 |
|
3 |
协助企业建立符合GMP规范的质量管理体系 |
双方,SUNGO全程辅导 |
3-6个月 |
|
4 |
产品备案申报 |
双方,企业支持,SUNGO编制资料完成申报 |
1-3个月 |
|
5 |
药监局备案审评、 整改 |
双方,SUNGO指导,完成整改申报 |
1-2个月 |
|
6 |
产品备案证书发放 |
NMPA |
1工作日 |
|
7 |
生产备案申报 |
双方,企业支持,SUNGO编制资料完成申报 |
5-10工作日 |
|
8 |
生产备案证书发放 |
NMPA |
1工作日 |
|
9 |
体系检查、整改 |
双方,企业支持,SUNGO指导迎审 |
2工作日 |
|
10 |
过程结束,可顺利生产 一类器械 |
N/A |
N/A |






