CE IVDR
2017年5月5日欧盟颁布Regulation (EU) 2017.746 on In Vitro Diagnostic Medical Devices体外诊断医疗器械法规,简称IVDR,并将于2022年5月25日正式生效,2022年5月26日实施。这代表着IVDR将于2022年5月取代1998年欧盟所颁布的Directive 98/79/EC of the European Parliament and of the Council on in vitro Diagnostic Medical Devices (IVDD)诊断试剂指令,标志着IVD的管理将以法规的形式对欧盟诊断器械进行监管。

IVDR于IVDD有着诸多差异,例如:
1、IVDR对公告机构的指定提出了更严格的要求,国家主管当局和委员会加强了控制和监督。
2、最大的变化在于体外诊断(IVD)设备的风险分类和公告机构(NBs)的作用,并且还明确了经济运营者(制造商、授权代表、进口商和分销商)的义务。
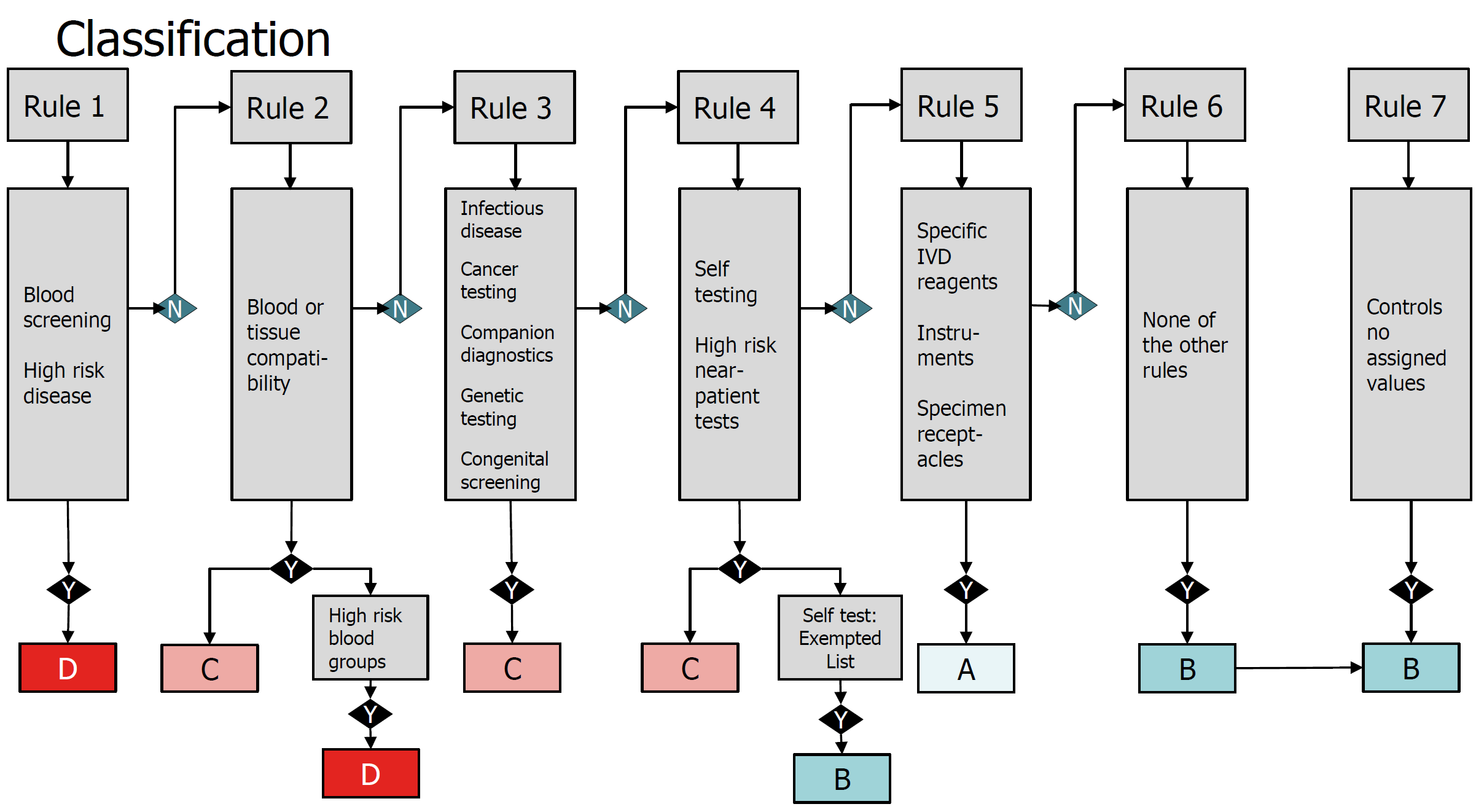
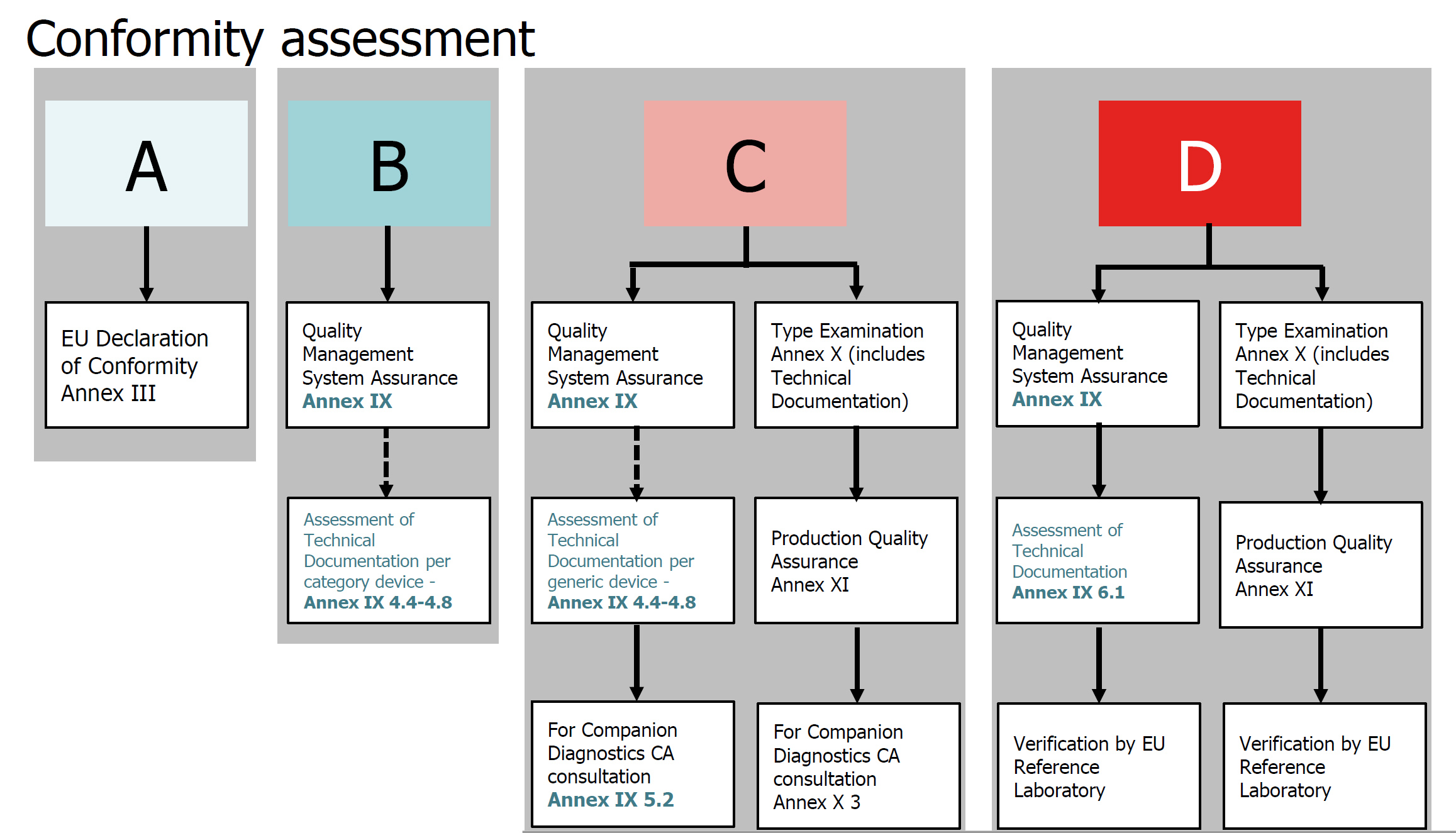
3、IVDD采用一种基于清单(List A, Lisa B及other)的方法来划分风险类别,从而决定评估符合性的过程和NB介入监管的程度。IVDR则使用国际公认的规则,将每个设备指定为四个风险类别之一(IVDR第47条),从A级(最低风险)到D级(最高风险),去掉以往other类的模糊慨念。
4、IVDR亦加强了对临床证据和合格评定的要求。大约85%的IVDs将需要公告机构的监管。对于伴随诊断,公告机构应根据附录 X 第 3 节(k)点规定的流程,特别咨询由成员国根据欧洲议会和理事会第 2001/83/EC 号指令指定的主管机构,或者欧洲药品管理局(EMA)(第四十八条)。
5、D类器械的符合性评估将需要欧盟参考实验室(如果指定为该类型设备)参与,以验证制造商声称的性能和符合适用的通用规格(第48.5条)。此外,创新型的Class D器械目前没有通用规格的设备,必须由一个独立的专家小组对制造商的性能评估报告提出意见(第48.6条)。生产的D类器件必须由欧盟参考实验室(如果指定用于该类型器件)进行测试。
6、IVDR呼吁增加透明度,因此有关IVD器械和“高风险”性能研究的相关资料将被公开。新的欧洲医疗数据库(Eudamed)将在提供更完整、准确并易获得的数据方面发挥核心作用。
7、IVDR中要求为每个IVD器械引入唯一的设备标识符(UDI),以显著增强可追溯性并为上市后安全活动提供支持。

2022年正式实施IVDR的时间变得紧迫,全新的产品分类及符合评价路径给诊断医疗器械厂商提出了更高挑战,上海沙格有着优秀的咨询师团队,丰富的案例经验,我们可以提供为您提供以下咨询业务。
我们的咨询业务
|
1 |
IVDR法规专业培训 |
DAY 1 PART 1 IVDR法规简介 PART 2 IVDR法规变化-风险分类与合格评定 PART 3 IVDR法规变化-UDI和标签 PART 4 IVDR法规变化-GSPR PART 5 IVDR法规变化-PMS系统 PART 6 IVDR法规变化-质量管理体系 PART 7 IVDR法规变化-欧代、注册、CFS |
|
DAY 2 PART 8 IVDR法规变化-技术文件 PART 9 IVDR法规变化-临床证据 PART 10 IVDR法规变化-风险管理 PART 11 IVDR转换实施建议 PART 12 Q&A |
||
|
2 |
专项辅导 |
IVDR法规变化-UDI和标签 IVDR法规变化-GSPR IVDR法规变化-PMS、PMCF系统 IVDR法规变化-质量管理体系 IVDR法规变化-技术文件 IVDR法规变化-临床证据,性能评估 IVDR法规变化-风险管理 |
|
3 |
欧代和注册服务 |
SUNGO 荷兰和德国公司可以提供欧盟授权代表服务,同时提供向当地监管部门申报注册的服务。 |
|
4 |
整体IVDR升级换版实施服务 |
包含上述1、2、3的全部内容,还包括针对公告机构审核开具的不符合的整改服务。 |
我们的服务流程
|
1 |
预评估 |
简要管理,以确保清楚了解IVDR的重要性和业务影响 预评估考虑组织的挑战:管理意识,人员配备能力和可用性,预算影响 |
|
2 |
差异分析 |
l 评估对产品、内部资源、组织和预算的影响 l 检查新的分类规则(IVDR A-D类)
l 并确认现有和产品的符合性评估路线
l 检查产品与关NB机构有关的要求 l 审查现有技术文档(技术文件)的变更 l 评估及更新质量管理体系(以下第3点) l 检查可用临床证据和风险管理的充分性,识别差异(第56条) l 评估产品标签(附件I第Il1章) l 确保上市后监督的安排充分适宜够(第七章第1节) l 制定上市后性能跟踪(PMPF,附件XIll B部分) l 做好迎接新的警戒需求的规定(第七章第二节) l 确保可追溯相关方面(第3章) |
|
3 |
质量体系评估 |
l 评估新IVDR法规下QMS符合标准和流程的程度 l 增加新法规应用于QMS的要求 l 协助和识别合规负责人(PPRC)并参与培训 |
|
4 |
公告机构NB |
l 选择合适的公告机构,确认公告机构资质及范围 l 建立新法规实施过渡计划 |
|
5 |
技术文件编制 |
l 编制符合IVDR要求的技术文件(TD) l 编制临床证据和风险管理等技术文件 l 指导产品设计开发流程,确保输入及输出的完整性 l 确认标签、上市后监督、上市后性能跟踪方案 l 技术文件整改(风险管理报告,临床性能评估报告,GSPR等) |
|
6 |
QMS |
l 更新现有体系中IVDR用于QMS的要求 l 定制企业合规QMS系统 l 执行体系实施计划确保覆盖各个方面及各方面责任 |
|
7 |
可追溯性UDI |
建立可追溯性QMS要求 建立UDI系统程序及制度 确认UDI的规划及实施 |