FDA医疗器械验厂
什么是FDA验厂?
美国食品药品监督管理局(FDA)每年会对注册的企业进行抽查以确认注册企业是否符合FDA相关法规要求。

医疗器械FDA验厂频次?
产品风险等级不同医疗器械生产企业被抽到验厂的频次会有所差异,一般情况下,一类产品大约3年左右会被抽查到一次,二、三类企业大约2年左右被抽到一次。另外,当企业产品被海关抽查到问题,或者在美国出现不良事件被抽查频次可能会增加。
医疗器械FDA验厂依据?
检查的依据是21CFR PART 820,又称为QSR820,21CFR803 Part MDR、21CFR Part 806、21CFR Part 801等相关法规。
FDA验厂通知形式?
FDA一般以邮件形式通知企业和美代。
FDA验厂是否提前通知?
一般情况下会提前1-2个月通知审核,同时也有到厂后FDA官员再通知情况发生。

收到FDA验厂邮件后应该怎么做?
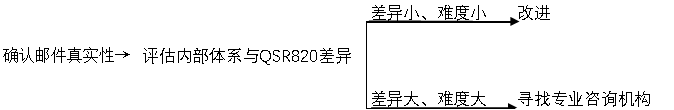
SUNGO作为全球化的医疗器械法规专业技术服务商,可提供服务
1. 协助企业建立符合21 CFR part 820要求的质量管理体系
2. 预审服务,识别企业现行体系和QSR 820之间的差异
3. FDA工厂检查现场陪审及翻译服务
4. 说明书标签审核服务
5. 设计开发评核服务
6. FDA 483不符合项整改咨询服务及回复
7. 根据企业的情况提供针对性的培训
SUNGO服务流程
流程
具体任务
分工
周期
1
建立满足QSR820体系及完善
双方
2-4周
2
识别企业现行体系和QSR 820之间的差异并提出整改建议
双方
1-2周
3
检查差异整改情况
双方
1-2周
4
陪审及翻译
双方
1周左右
5
FDA 483不符合项整改
双方
2周左右







