MDSAP认证
1. 什么是MDSAP认证
MDSAP,即医疗器械单一审核程序(Medical?Device?Single?Audit?Program?(MDSAP)?)项目是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套医疗器械审核程序。

该程序旨在建立一套单一审核的过程,满足并统一上述国家的审核要求,使审核更加全面有效。以上五国监管机构认可MDSAP的审核结果,生产企业可以减少对应不同监管机构的审核次数,减少因审核带来的生产干扰。2017年1月正式实施。
2. 谁来认证MDSAP?
MDSAP由医疗器械生产企业联系第三方公告机构(如:SGS、BSI、TUV)进行审核,参与国(五国:美国、澳大利亚、巴西、加拿大、日本)的医疗器械监管部门可以将此审核报告作为判断依据。?具备MDSAP审核资质审核机构Auditing Organizations(AO)可查看以下链接:https://www.fda.gov/media/137394/download
3. 谁认可MDSAP认证?
五个参与国家认可的程度如下:
美国:替代FDA的常规检查(FDA专项和PMA产品除外);
巴西:对于三类和四类医疗器械,可以替代ANVISA的上市前GMP检查,以及上市后的例行检查(专项检查除外);
日本:对于II类,III类,IV类医疗器械,可豁免现场工厂审核;
加拿大:2019年起MDSAP证书取代原CMDCAS证书,作为分类在II类及以上产品进入加拿大市场时,证明其质量管理体系合规的的唯一有效证明;
澳大利亚:可豁免TGA审核,支持颁发和保持TGA符合性审核证书

4. MDSAP认证流程
1)企业识别MDSAP法规,建立符合MDSAP要求的质量管理体
2)向审核机构(AO)提出认证申请,签订认证合同;
3)审核机构(AO)到企业现场进行审核;
4)企业根据审核机构(AO)审核提出的整改项进行整改,提交整改计划;
5)审核机构(AO)审核企业的整改情况;
6)审核通过,审核机构(AO)颁发MDSAP证书。
5. SUNGO作为全球化的医疗器械法规专业技术服务商,可提供服务:
1) MDSAP专项培训服务;
2) 辅导企业建立符合MDSAP要求的质量管理体系;
3) 分析现有体系和法规要求之间的差距;
4) 模拟审核,帮助企业识别薄弱环节;
5) 现场陪同审核;
6) 辅导企业进行审核后的整改及整改回复。
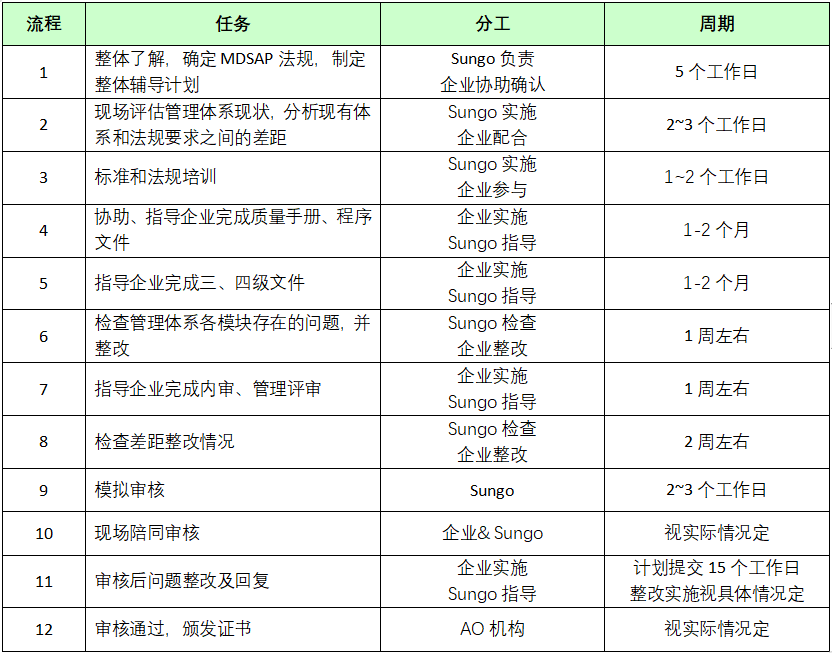
6. SUNGO服务流程: