加拿大医疗器械认证注册
根据加拿大医疗器械法规(CMDR),按产品风险程度将医疗器械分为 I, II, III和 IV四个等级, 风险等级逐次递增,I类器械为最低风险,IV类器械风险为最高。此针对制造者提出的产品注册要求也是逐级增加,要求制造者实行的体系是愈加详尽。
如果您计划进入加拿大市场,则需要进行产品注册登记以获得许可证书,加拿大卫生部颁发医疗器械机构许可证书(MDEL)和医疗器械许可证书(MDL)两种不同类型证书,并有不同要求。
加拿大医疗器械机构许可证书(MDEL)
1. 什么是MDEL
MDEL是Medical Device Establishment License 的简称,即医疗器械机构许可证书。如果想要生产一类医疗器械并出口至加拿大,您必须获得加拿大卫生部医疗器械机构许可证书(MDEL)。MDEL是对于机构的经营许可,无论医疗器械属于哪个类别,医疗器械经销商与进口商都必须获得MDEL许可证书。
2. MDEL申请基本流程
(1) 企业为申请Medical Device Establishment License (MDEL)准备相应的文件,
(2) 提交MDEL申请,支付卫生部行政收费。
(3) 申请评审通过,将在Health Canada网站公示。
3. 下列几类情况能够豁免 :
(1)零售商
(2)医疗保健企业
(3)在加拿大市场销售企业名下获得医疗器械产品注册证的II类III类和IV类的医疗器械产品的制造厂商 (注:如果是市场销售其他企业名下获得医疗器械产品注册证的II类III类和IV类的医疗器械产品的制造厂商 ,也必须申请办理MDEL )
(4)I类医疗器械产品的制造厂商,根据拥有医疗器械产品营业许可证(MDEL)的企业在加拿大市场销售医疗器械产品 ,则无需申请办理MDEL 。
4. MDEL的有效期限
MDEL没有标明有效期限 ,但MDEL持有者一定要在每年4月1日前递交年度审核申请,MDEL才被视为继续有效,否则MDEL会被撤销 。
MDEL被撤销后,在加拿大的器械市场销售活动则也会被禁止。如果MDEL被撤销 ,MDEL持有者一定要再次申请办理并缴费,才能够再次获得MDEL,申请成功后,会发放一个新的MDEL许可证。
5. 申请MDEL需要完成申请表的如下内容,提交后2-4周可以获得证书。
(1) 公司名称及联系方式
(2) 许可文件、邮寄和帐单地址
(3) 分类和活动表
(4) 场地地址
(5) 制造商信息
(6) 证明
(7) 签名
6. MDEL证书示例

加拿大医疗器械许可证书(MDL)
MDL是 Medical Device License 的简称,即医疗器械许可证书。MDL是对产品的批准。生产二类及以上类别的医疗器械销售至加拿大,则必须获得加拿大卫生部医疗器械许可证书Medical Device License (MDL)。
对于II, III和 IV类医疗器械,申请MDL认证前,还必须满足MDSAP审核认证。
1. 什么是MDSAP认证?
MDSAP,是Medical Device Single Audit Program的简称,即医疗器械单一审核程序。它是由国际医疗器械监管机构论坛(IMDRF)的成员共同发起的项目,旨在由具有资质的第三方审核机构,对医疗器械生产商进行一次审核即可满足参与国不同的QMS/GMP要求。
MDSAP自2019年起强制取代CMDCAS,作为分类在II类及以上产品进入加拿大的唯一途径。
2. 如何申请MDSAP认证
(1) 聘请专业医疗器械第三方服务机构,建立符合MDSAP要求的质量管理体系:
(2) 企业识别MDSAP法规,由质量管理部按照MDSAP的要求进行内审;
(3) 由公告机构到企业进行现场审核;
(4) 企业根据公告机构审核提出的整改项进行整改,15天内提交整改计划;
(5) 公告机构审核企业的整改情况;
(6) 审核通过,公告机构内部走出证审批程序,颁发MDSAP证书。
3. MDL申请基本流程
II类:
(1) 通过MDSAP审核认证,获得证书。
(2) 准备Canadian Medical Device License (MDL)申请。
(3) 提交MDL申请,并交纳卫生部行政收费。
(4) Health Canada评审MDL申请,评审通过后将在网站公示。
III和 IV类:
(1) 通过MDSAP审核认证,获得证书。
(2) 准备Canadian Medical Device License (MDL)申请。
(3) 提交MDL申请和Premarket review documents,并交纳卫生部行政收费。
(4) Health Canada评审MDL申请和Premarket review documents,评审通过后将在网站公示。
SUNGO作为全球化的医疗器械法规专业技术服务商,可提供服务:
1. 确定您的医疗器械在加拿大的具体分类;
2. 帮您申请加拿大MDEL和MDL;
3. 协助您按照MDSAP建立医疗器械质量管理体系;
4. 提供MDSAP专项培训服务;
5. 确定每年应向加拿大卫生部缴纳的许可证费用;
6. 协助您与加拿大卫生部联络。
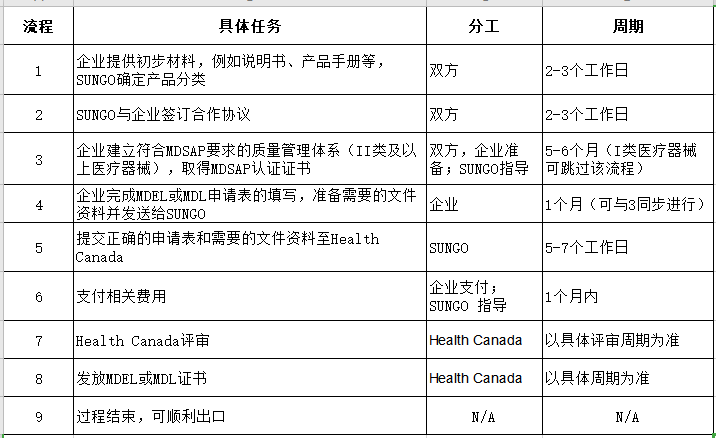
SUNGO服务流程: