1. 法规依据
21 CFR part 830 唯一医疗器械标识
- 定义 贴标商
- UDI要求
- FDA认可发布机构
-
全球唯一设备数据库GUDID
– 贴标商信息(名称、联系人、发布机构)
– 设备版本/型号
DI 、先前分配的DI(新设备替代以前标识符)、设备直接标记、品牌名称、版本/型号、是否无菌、是否含有天然乳胶、是否宣称MRI、尺寸、生产标识符类别、PMA/510K、列示号、GMDN码、设备数量
21 CFR part 801 标识
Subpart B--Labeling Requirements for Unique Device Identification
- 医疗器械的标签符合唯一器械标识符(UDI)要求
-
例外
– 合规日期之前生产并标注的成品设备
– 豁免GMP的I类设备
– 单独一次性设备
– 研究、教学或分析设备
– 自定义设备
– 调查设备
– 兽用设备
– 出口的设备
– 国家战略储备持有的一种设备
– 法规认可的例外设备
– 包装在组合产品或便利工具包中的设备
– 国家药品编码(NDC)编号-组合产品
– 运输包装
– I类设备的UDI不需要包含生产标识符
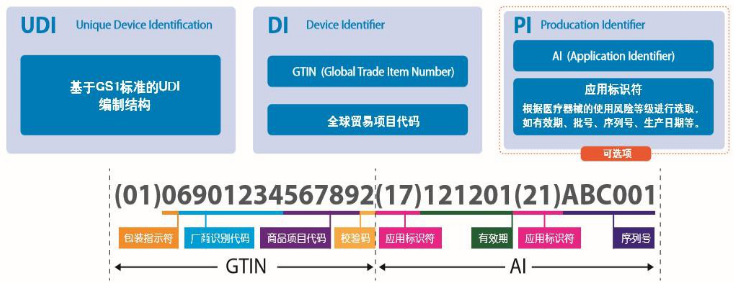
2. UDI 结构
唯一器械标识'UDI” – Unique Device Identifier
UDI 是通过全球接受的器械标识和编码标准来创建的一系列数字或字母数字字符, UDI 由UDI - DI 和UDI - PI 组成。
设备标识符(DI)-UDI的一个强制的固定部分,用于标识医疗器械的特定版本或型号。
生产标识符(PI),UDI的一个有条件可变部分,当包含在设备标签上时,识别以下一个或多个内容:
- 生产设备的批号
- 特定设备的序列号
- 特定设备的到期日期
- 制造特定设备的日期
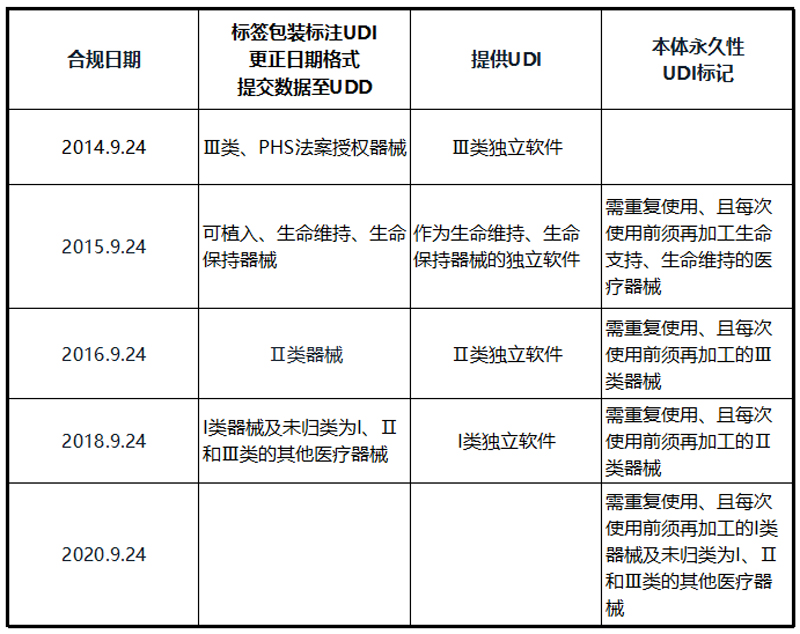
3. UDI 合规日期
4. GUDID的申请流程
1)识别Labeler;
2)申请账户前准备:申请DUMS Number(邓白氏码)、一个有效的 FDA Premark Number (510k或PMA等)、选择公告机构并申请他的条码;
3)填写“FDA Global Unique Device Identification Database (GUDID) New Account Request”,以邮件形式申请GUDID账户;
4)在GUDID上提交信息,必要的信息填写完成后,将在发布日期开始对外公布。发布后原则上不能修改。
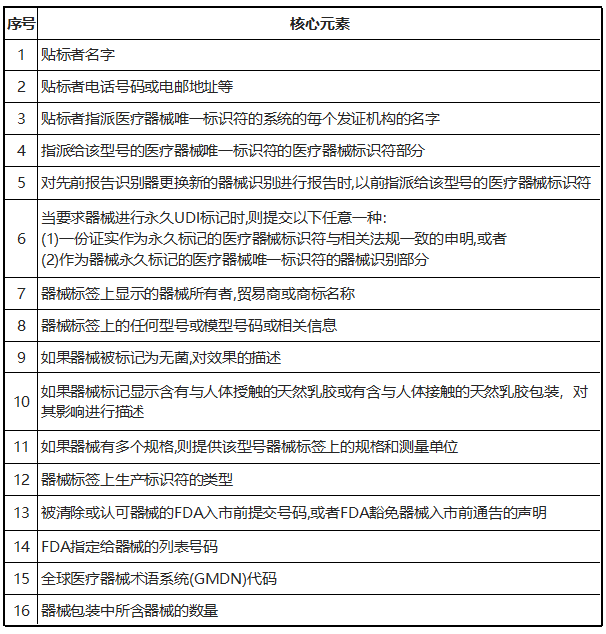
5)GUDID的核心元素