
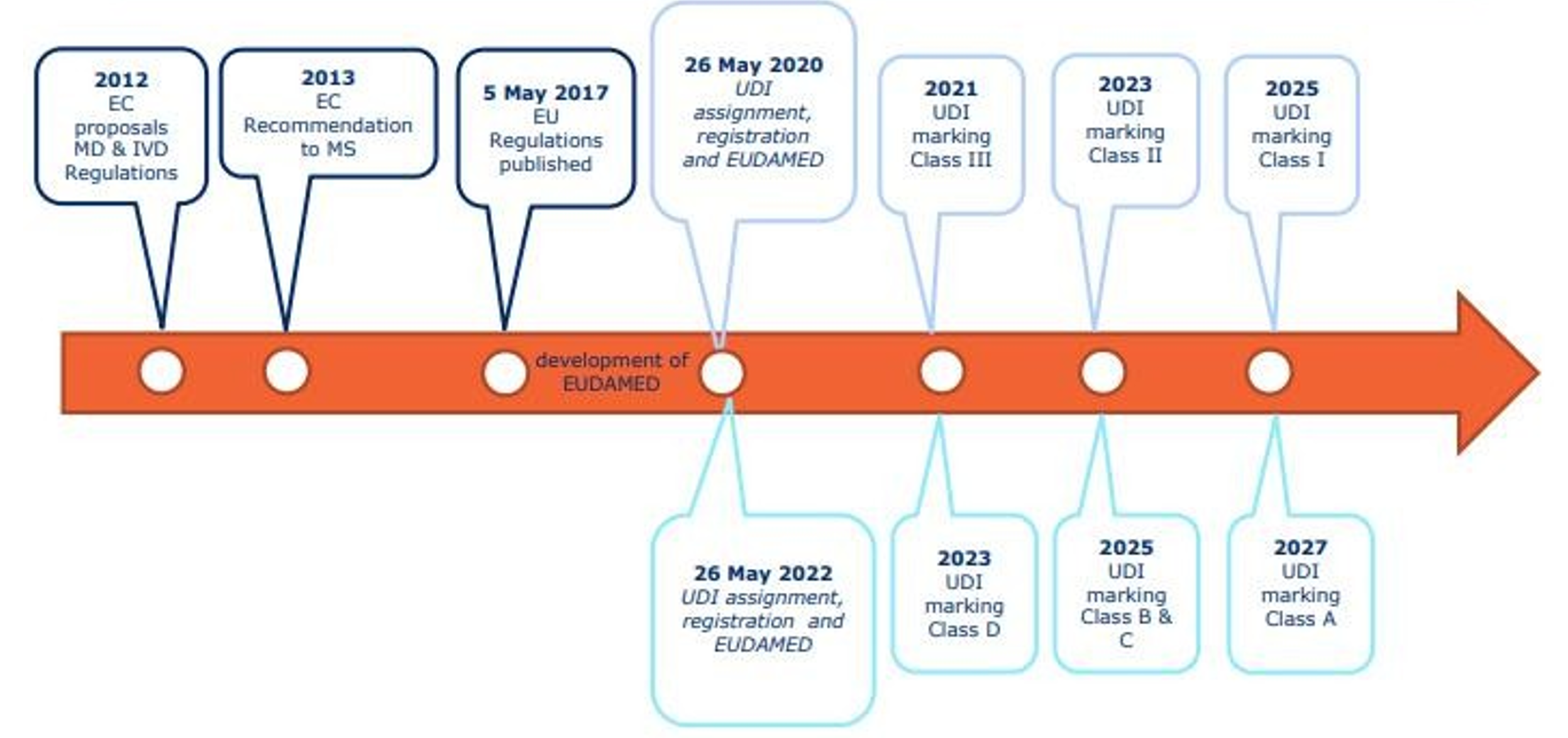
1. 合规时间
欧洲的UDI合规的时间表见下图,按照风险等级的差异合规的时间进度也有差异,覆盖了MDR和IVDR下的所有产品。
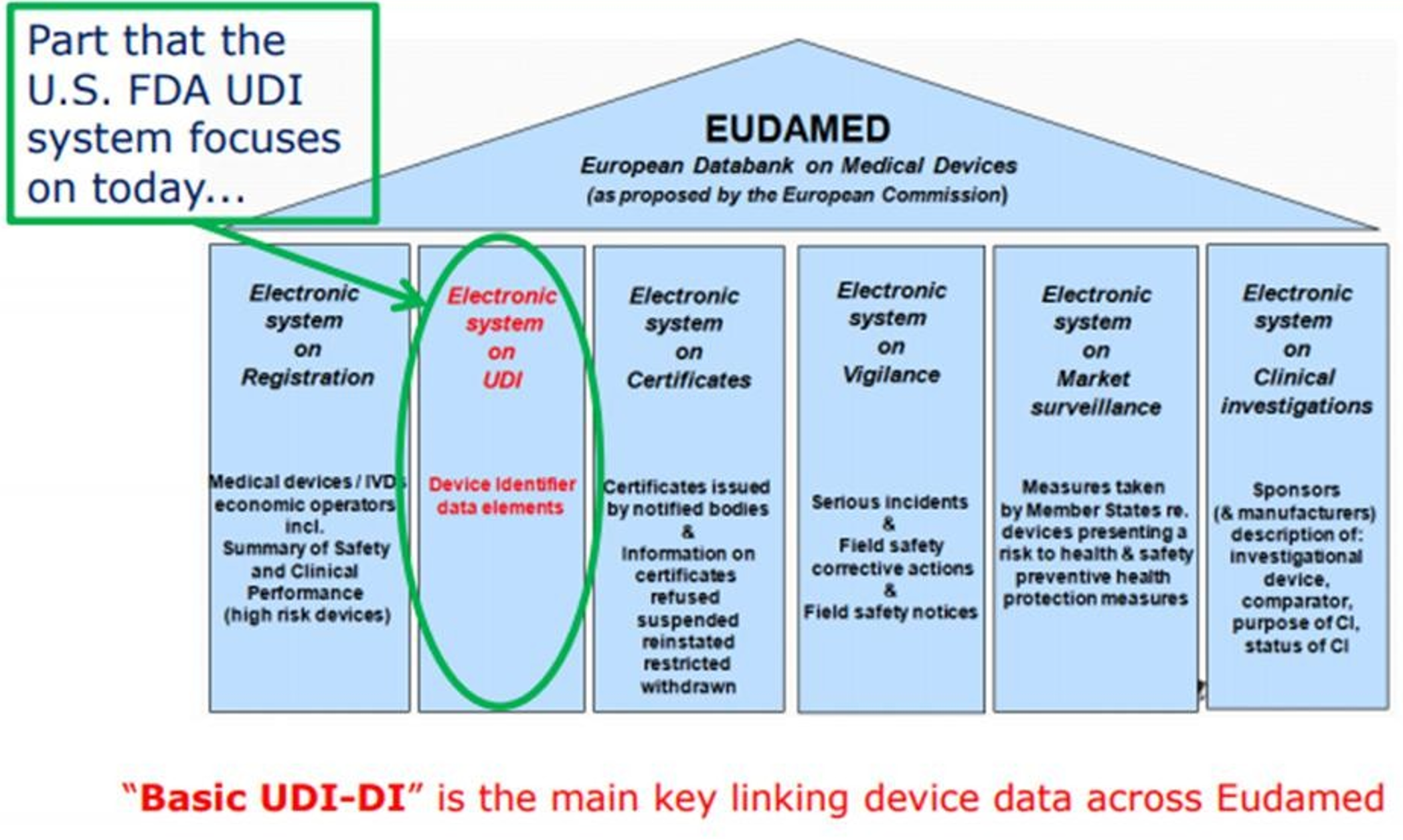
2. UDI构成EUDAMED数据库
EUDAMED 数据库包含了数个模块,其中有一个模块就是UDI模块。
3. UDI(唯一器械标识)的实施
1)UDI 应位于器械本身或其包装上,更高级别的包装应有其自己的UDI;
2)运输容器应豁免第3.1 节要求。例如,物流设备上无需有UDI;当医疗服务机构订购多台使用UDI 或单个器械型号的器械,而且制造商将这些器械放置在一个容器内运输或用以保护单独包装的器械时,不得要求运输容器(物流设备)上有UDI;
3)UDI 应包含两部分:UDI - DI 和UDI - PI;
4)UDI - DI 在各级别的器械包装上均是唯一的;
5)若标签上出现批号、序列号、软件标识或过期日期,则其将是UDI - PI 一部分。若标签上同时还标有生产日期,则UDI - PI 中无需包含生产日期。若在标签上只有生产日期,则应将其用作UDI - PI;
6)被视为器械且可在市场上购买的各组件应有其单独UDI,除非此类组件是以单独UDI销售的可配置器械的一部分; 7)应分配第22 条所述的系统和程序包并承担自身的UDI;( 追溯性 )
8)制造商应根据以下编码标准为器械指定UDI;
9)在有可能导致器械的错误识别和/或其追溯性不明确时,尤其是以下任何UDI 数据库元素发生的变化需要新的 UDI - DI 时,将需要提供新的UDI - DI;
10)重新包装和/或重新安装器械的制造商,使用自身的标签,且应保留原始设备制造商(OEM)UDI 的记录。
4. UDI的数据库申报信息
根据第28 和29 条提供给UDI 数据库的核心数据元素与UDI-DI 制造商应向UDI 数据库提供UDI-DI 以及与制造商和器械相关的以下信息:
1)各程序包配置的数量;
2)第29 条所述的基本UDI - DI 和额外UDI - D;
3)控制器械生产的方式(到期日期或生产日期、批号或批数、序列号);
4)如适用,“UDI-DI”使用单位(未给器械标签UDI‘使用单位’时,应规定DI ‘使用单位’,以便将器械的使用与患者关联起来);
5)制造商的名称和地址(如标签所示);
6)按照31(2)条签发的SRN ;
7)如适用,授权代表的名称和地址(如标签所示) ;
8)第26 条规定的医疗器械命名法规 ;
9)器械的风险等级;
10)如适用,商品名或商标名称;
11)如适用,器械的型号、参考号或目录号;
12)如适用,临床尺寸(包括体积、长度、规范、直径);
13)额外的产品说明(可选);
14)如适用,存储和/或处理条件(如标签或使用说明所示);
15)如适用,器械的额外商品名;
16)标记为一次性使用器械(是/否);
17)如适用,重复使用最大次数;
18)标记为无菌的器械(是/否);
19)使用前需消毒(是/否);
20)标记为含胶乳(是/否),
21)如适用,按照附录I 第10.4.5 节标记的信息;
22)额外信息的URL,如电子使用说明(可选);
23)重要警告或禁忌(如适用);
24)器械状态(市售、不再市售、召回、现场安全纠正措施启用)。






