MDR技术文件要求
1. 技术文件的结构和内容
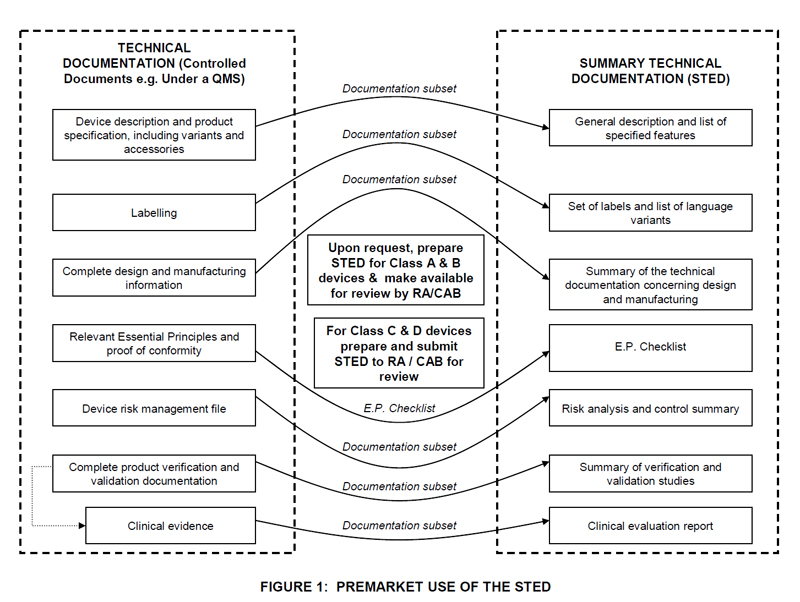
技术文件需要采用STED的结构来进行编写。
STED 是由原GHTF编制的对于技术文件编写结构的指南。STED的结构通常包括如下:
1) 器械描述
2) 标签包装
3) 产品设计和生产
4) 基本要求
5) 风险分析
6) 验证和确认
2. 技术文件的注意事项
技术文档必须在设备的设计和开发过程中形成,并在整个生命周期中进行维护。如图1所示,这个过程可以使用V-model表示,因为它交付文档和记录,这些文档和记录形成了设计历史文件(DHF)。
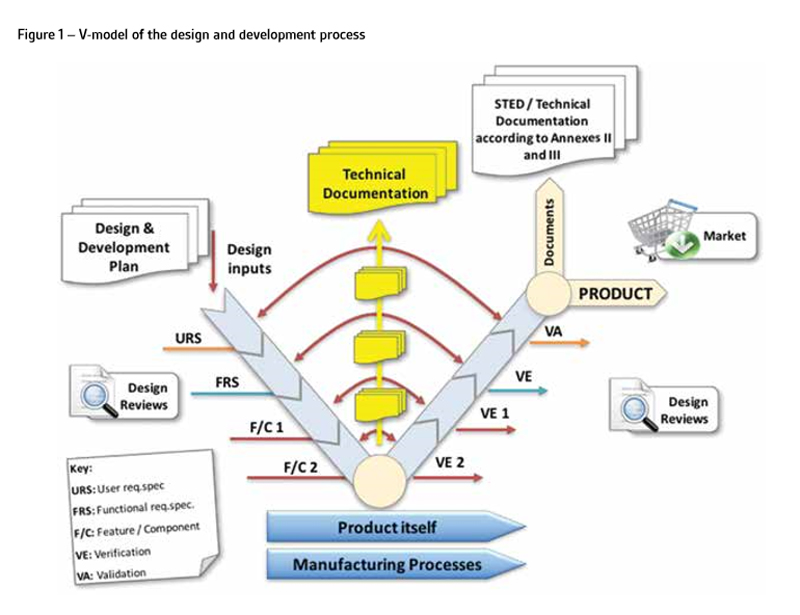
技术文档代表描述设备的所有文档。因此,它包括设备的设计、开发、V&V(包括临床和性能验证)以及它在目标市场的监管地位。此外,MDR现在需要一个闭环的过程,实现数据从上市后使用设备(PMS),为了确保捕获早期预警的总体安全性和性能需求(GSPRs) 2不断满足和对病人的好处总是大于风险。
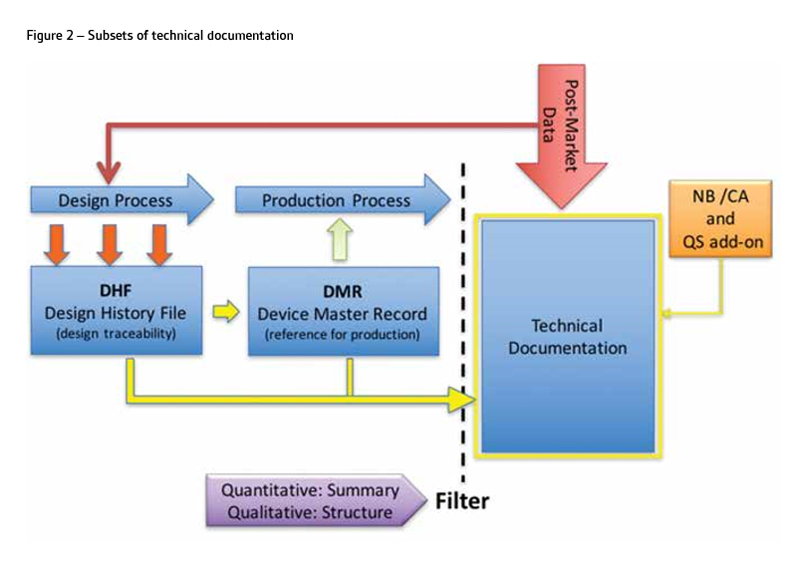
应以结构化的方式,以促进NB审查和评估(图2)的方式呈现技术文档。这意味着技术文档的编制需要的应用定量和定性过滤器,允许一个适当的水平的细节保持,同时避免将多余的细节没有必要证明满足GSPRS。