
1、合规时间图
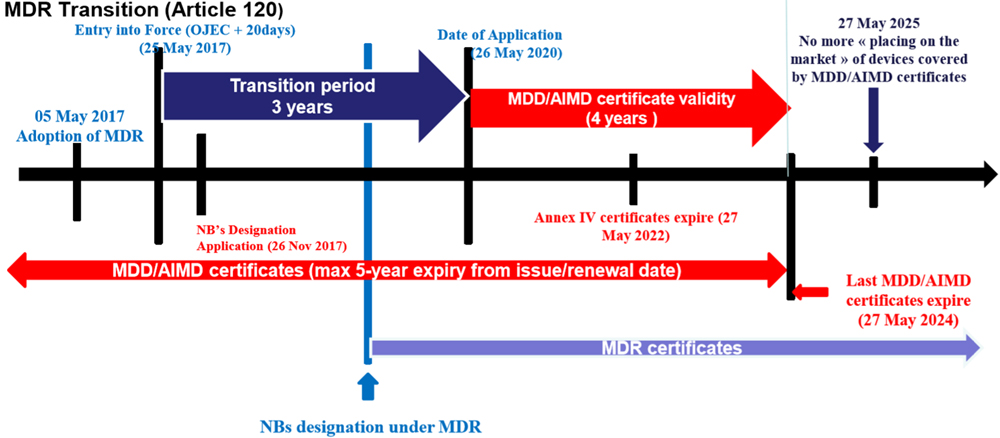
特别说明的是,由于COVID-19疫情的影响,MDR实施日期推迟到2021年5月27日。
2. 合规时间解释
1) 从2021.5.26开始,任何公告机构不能再签署MDD、AIMD的CE证书;
2) 在MDR生效前获得MDD 和AIMD CE证书,在其5年有效期内继续有效。
3) 2017.5.26至2021.5.25期间,仍可申请MDD证书,有效期5年,但不能超过2024.5.27(MDD附录IV路径和AIMD附录4路径获得的证书最迟在2022.5.27日失效)
4) 但上条所述日期之前已投放到欧盟市场的产品,可继续销售和使用到2025.5.27。
5) 从2024.5.27开始,产品不能再持有MDD证书清关投放市场,但在此之前已投放市场的产品,可继续销售和在客户端使用至2025.5.27日;
6) 2020.5.26日后,产品上市后的监督管理等活动,必须遵守MDR指令的要求;
7) 如果MDD下的产品在2025.5.27前还没有交付使用,则2025.5.27之后,GAME OVER。即便是已经进入欧盟了,只要还没交付给医院使用,医院也不能再接收。
8) 由于2021.5.26日起,任何公告机构不能再签署MDD AIMD CE证书,故在之后继续使用MDD AIMD CE证书的制造商应确保:
· CE证书上任何内容不再发生变化,如新类别,新场地等。
· 已上市产品没有设计和预期用途上的重大变更,也不能同类别增加新型号。
如变化,必须重新申请MDR证书。
3. 对于I类器械的合规时间探讨
1)对于原来是自我声明模式,在MDR法规时候变更为公告机构参与合格评定模式的,其合规日期为2024年5月27日;
2)对于在新旧法规均为自我声明模式的I类器械,建议从2021年5月27日开始就按照MDR法规来准备合规证据。






