
北爱尔兰的独特之处
1. CE MDR/IVDR的适用性
欧盟MDR和IVDR分别于2021年5月26日和2022年5月26日生效。即使在2023年7月1日之后,销往北爱尔兰的设备仍将继续需要CE标志并满足欧盟规则。在2021年1月1日之前英国NB颁发的CE证书将在该日期之后不再被NI市场认可。
2. UKCA的适用性
英国批准的机构将能够根据指令对NI市场进行合格评估(UK MDR 2002),UK(NI)标记可加贴,但不能代替CE标记。同时带有CE标志和UK(NI)标志的产品不能在欧盟市场上投放。除非带有CE或CE UK(NI)标记,否则UKCA标记的设备将不会在北爱尔兰市场上接受。
3. 什么样的产品标记将带您去哪个市场?
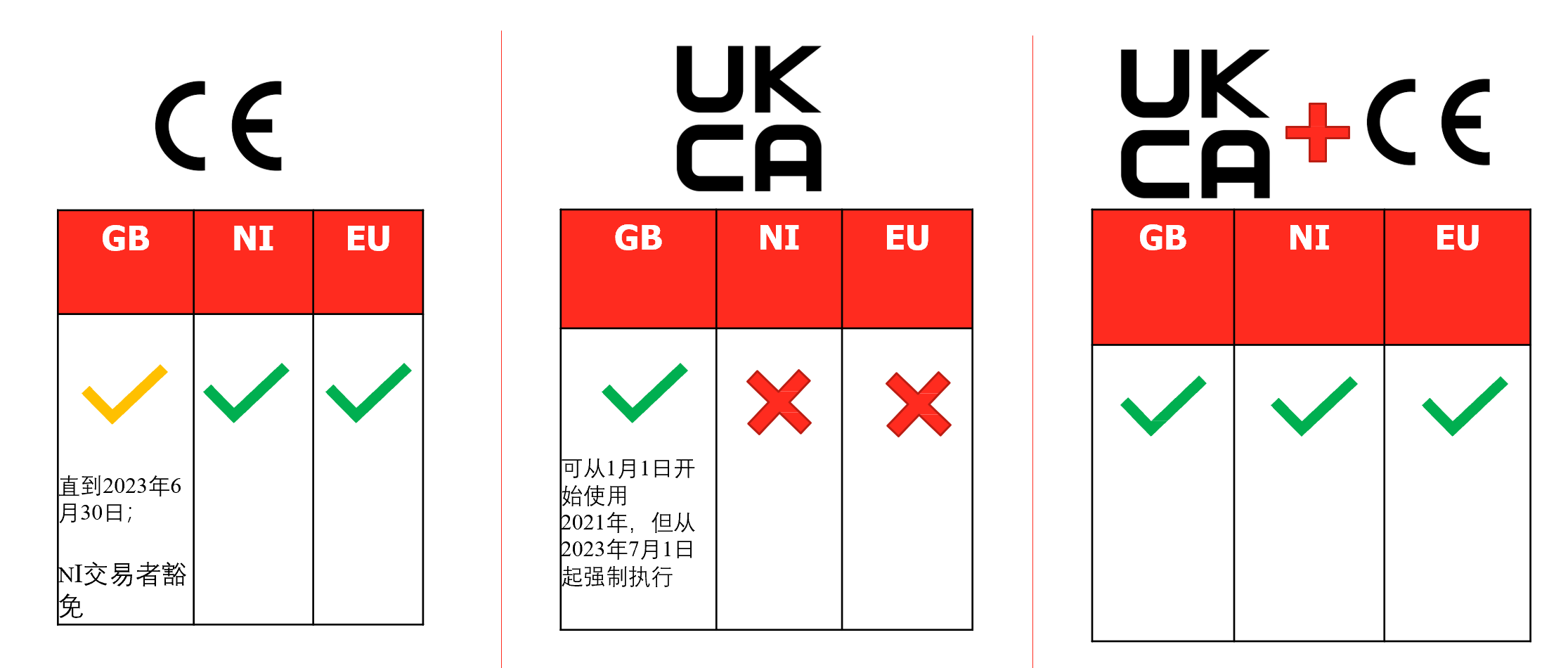
4. 关于欧盟授权代表和英国代表的要求
对于需要将医疗器械产品销往北爱尔兰的制造商:
如果你位于欧盟以外,你需要指定位于北爱尔兰的欧盟授权代表或者英国法规负责人;
如果你位于欧盟成员国,你需要指定英国法规负责人;
如果你是位于英国(除北爱尔兰外),你需要指定欧盟授权代表;
如果你是位于北爱尔兰,你不需要指定任何代表。





